ブログ
ブログ一覧
エンドトキシン再考②
引き続きエンドトキシンについえ考える
前回は
前回エンドトキシンについて
- 粗飼料多給牛群の第1胃でもエンドトキシンは存在し、第1胃静脈血液中にも存在するが末梢血液では検出されない。
- 配合飼料を多給すると第1胃、第1胃静脈血液中のエンドトキシン濃度は著増し、末梢血液中にエンドトキシンが検出される。
- 肝臓に流入するエンドトキシン濃度が40 pg/mlを超えると肝臓でのエンドトキシンの解毒限界を超え、溢れたエンドトキシンが末梢血液中に流入、エンドトキシン血症を発症する
- 腸管からのエンドトキシン吸収もある
という論文について紹介しました。
まずアシドーシスについて
育成牛後期や肥育牛では給与する配合飼料が増え第1胃が酸性に傾くのは致し方無いのです。粗飼料多給牛の第1胃phはどれくらいかというと6.8~7.0くらいです。
ではルーメンアシドーシスでのphはどうでしょう?急性アシドーシスではph5.5以下になります。今ではあまり無い様に思います。あるいは地域や飼養形態によってあるのかもしれませんが。
急性アシドーシスは処置を迅速に行わないと牛が死亡します。第1胃が急激に酸性に傾くと牛の体は第1胃の酸性を薄めようと体の水分を第1胃に移動させます。そのため急激な脱水症状が見られ、併せて水様性の下痢もしますから急激に体水分が喪失します。大量の点滴で体水分量の確保とphの補正(重曹の点滴)を行い、強肝剤の投与、必要に応じて胃洗浄などを行います。
昔遭遇した急性アシドーシスで多かったのは牛が牛房から脱走して置いてある配合飼料やトウモロコシ圧ペンを盗食したというケースです。
希なケースで給餌車で育成牛に与えるべき配合飼料を間違って肥育牛舎へ給餌してしまい、喜んだ肥育牛がおいしい育成飼料を食べ過ぎて急性アシドーシスでバタバタ倒れて、何頭も同時に点滴したなんて事もありました。
もっと一般的に育成牛や肥育牛で見られるアシドーシスは亜急性アシドーシスです。亜急性アシドーシスといわれる病態では第1胃のphは5.6~5.8の状態が1日3時間以上あり、それ以外の時間はph5.8以上に回復するという変化が起きています。
ルーメンパラケラトーシスを知ってますか?
第1胃不全角化症ともいいます。
まず角化とはから見てみます。ヒトの肌でいうと皮膚表面は角質層であり、その下に順に顆粒層、有棘層、基底層があります。肌細胞は基底層で基底細胞として生まれ、有棘細胞、顆粒細胞、角質細胞へと順に押し上げられていきます。最表面で角質細胞になる事を角化(角質化)といいます。
角質細胞は表面で肌を守る働きをします。角化不全はそれが正常に行われない状態です。
またヒトで説明しますがヒトの肌細胞は28日で新しい細胞に入れ替わります。ターンオーバーというらしいです。
メイクや間違った洗顔などで角質細胞が乾燥や刺激を受けると28日より早く剥がれ落ちてしまします。すると未成熟な細胞が角質層に押し上げられます。ただ未成熟な細胞ですので肌を守る機能も弱いのです。
これと同じ事が第1胃の粘膜で起こります。原因は酸です。つまりアシドーシスです。
第1胃粘膜細胞が剥がれ未成熟な細胞が表層に出てきますが、また酸により剥がれ落ちる。それを繰り返す事で第1胃粘膜が剥げ落ちて吸収能力が低下する、あるいは角化出来ない絨毛同士がくっついて塊になってしまい、バリア機能も失う事になります。
次に引用する文献では第1胃静脈から肝臓へと流れ込むエンドトキシンの動態とは別に、ルーメンパラケラトーシスがエンドトキシン動態に与える影響を調べています。
なお、引用文中のLipopolysacchride(LPS)はエンドトキシンと同じ意味です。「牛のエンドトキシン血症における第一胃運動、第四胃運動および肝臓への影響(産業動物臨床医誌10(1):1-16,2019の試験では
全頭(5頭)について粗飼料主体の給餌(1日あたり乾草6kg、市販の配合飼料3kg)を4週間行い馴致した後、濃厚飼料受胎の給餌(1日あたり乾草1kg、配合飼料3kg、圧ペンn大麦5kg)に切り替えて4週間の制限給餌を行った。濃厚飼料主体の給餌に切り替え後、定時ごとの採材と臨床症状の観察を行い4週間後に病理解剖検査を実施した。
結果は
第1胃パラケラトーシスおよび肝臓の巣状壊死が認められた牛(№.3~5:3頭)と全臓器に病変がない牛(№.1~2:2頭)の2群に大別された。
また臨床症状は
臨床症状については、試験の全期間を通して全頭(5頭)において特段の臨床症状はみとめられず、採食量にも変化は認められなかった。
第1胃液のphは
第一胃パラケラトーシス群と病変なし群の間で第一胃液phの変動に違いは認められなかった。また両群ともに軽度の第一胃アシドーシスを生じた。
第1胃エンドトキシン量の結果は
第一胃液のLPS濃度は、両群ともに飼料変換1日後から増加が始まり7~14日後にかけてLPS濃度の増加ピークを迎える、ほぼ同じ変動を示した。
血液中のエンドトキシン濃度の結果は
血清LPS濃度は、第一胃パラケラトーシス群についてはPreではLPSは検出されないが飼料変換1日後には2.53±3.6 pg/mlと検出され、7日後にピーク値(10.2±2.9 pg/ml)を示し、28日後には5.3±3.9 pg/mlになった。血清LPSは第一胃パラケラトーシス群の全頭(3頭)で検出された。一方、病変なし群では、試験の全期間を通じて全頭(2頭)で血清中にLPSは検出されなかった。
とある。つまり
- 濃厚飼料主体の給餌をしたところ3頭はルーメンパラケラトーシスと肝臓の巣状壊死が認められ、2頭は全臓器に異常が無かった。
- 5頭全頭で臨床症状は認められなかった。
- 第1胃液のphは両群で変化は無かった。
- 第1胃エンドトキシン濃度は両群で同じ変動を示した。
- 第1胃パラケラトーシス群は血液中にエンドトキシンを検出したが、病変なし群は血液中にエンドトキシンを検出しなかった。
ルーメンパラケラトーシスを防ぐ事がエンドトキシン血症を防ぐ事になる
エンドトキシン血症になったらどのような弊害があるのか?についてはまたの機会にする事にしますが、100%でないにしてもルーメンパラケラトーシスを防ぐ事がエンドトキシン血症を防ぐ事になるって事です。100%ではないというのは前回のブログの「肝臓に流入するエンドトキシン濃度が40 pg/mlを超えると、肝臓の解毒の処理限界を超え、血液中にエンドトキシンが溢れる」という研究結果があるからです。また、感染したグラム陰性菌が死滅した場合のエンドトキシン血症についてはルーメンパラケラトーシスとは関係ないため防ぐ事は出来ません。
いずれにしろ亜急性アシドーシスを防ぐ事がエンドトキシン血症の発生をある程度防ぐ事になるという事になります。
エンドトキシン再考
再び牛とエンドトキシンについて考えてみる
肉牛とエンドトキシン
最近エンドトキシンに取り憑かれております。勉強すればするほどエンドトキシンの沼にはまっていく感覚。
搾乳牛であれば(専門ではありませんので詳しくありません)分娩にまつわる周産期疾病など様々な原因による、様々な疾病があると理解していますが、肉牛について考えるとエンドトキシンが関与する疾病が非常に多いという意味でとても重要です。
もちろん目の前で起きている子牛の下痢や肺炎など個別の病気の予防や治療に対して日々対応しているのですが、もう少し俯瞰で、肉牛における問題の多くにエンドトキシンが関与しているという視点で見てみたいと思います。
改めてエンドトキシンとは?
エンドトキシンとはグラム陰性菌に分類される細菌(一つの細菌ではなく複数の細菌)の外膜の構成成分であるリポ多糖体の事です。つまりグラム陰性菌は毒を持っていると考えても良いという事です。
ではグラム陰性菌とは何?という疑問が出てくるでしょう。全ての細菌はグラムさんという人が考案した染色法で紫色に染まる菌類=グラム陽性菌と赤く染まる菌類=グラム陰性菌に分ける事が出来ます。それぞれ菌体の外壁(外膜)の構造が違う事によります。これはたいして重要ではありません。
つまりエンドトキシンとはグラム陰性菌の外膜成分であり、グラム陰性菌が死滅すると放出される毒素であるという事です。
グラム陰性菌は牛のどこにいるのか?
そもそも牛の体内にグラム陰性菌が居なければ「エンドトキシンによる様々な障害」は起きないわけです。彼らはどこに居るのでしょうか?
- 第1胃の中 第1胃の中には牛が食べた粗飼料や配合飼料を分解するために多くの細菌がおり、その中にはグラム陰性菌もいます。
- 感染した細菌 元々は牛の体の中に居なかったグラム陰性菌に感染した場合です。例えばサルモネラ菌、大腸菌、パスツレラ菌やマンヘイミア等の菌です。(注意:大腸菌やパスツレラ菌は既に体に居る常在菌であり、牛の抵抗力が弱った時に発症する日和見(ひよりみ)菌であるという考え方も出来ますが、出生子牛の体の中にはおらずその後感染したと考えれば感染した細菌であると言える)
グラム陰性菌はなぜ死ぬのか?
第1胃の中のグラム陰性菌の場合
細菌にも人でいう寿命はあります。なので常に死んだグラム陰性菌は牛の第1胃に居ると言っても過言ではありません。その場合にもエンドトキシンは放出されます。しかしながらその程度の量のエンドトキシンは肝臓で分解、解毒されるので牛に悪影響を及ぼす事はありません。
結論から言えば牛の第1胃の中のphが酸性に傾きすぎると大量のグラム陰性菌が死滅するという事です。
感染した細菌の場合
感染した細菌が増殖して牛に何らかの症状が出てくれば当然治療することになります。その細菌に効果がある抗生物質を使うことでそのグラム陰性菌は死滅する事になります。
放出されたエンドトキシンの行方
「牛のエンドトキシン血症における第一胃運動、第四胃運動および肝臓への影響」(産業動物臨床医誌10(1):1-16,2019)で、敢えて濃厚飼料を多給してルーメン内のエンドトキシン濃度、第1胃静脈血内のエンドトキシン濃度、頸静脈血内のエンドトキシン濃度の変化を比較する実験がなされている。なお、引用文中のLipopolysaccharade(LPS)はエンドトキシンと同じ意味です。
試験方法は
供試牛を粗飼料多給群(3頭)と濃厚飼料多給群(5頭)に分けた。粗飼料多給群には試験期間を通じて1日あたり乾草9kg、市販の配合飼料3kgを給餌した。濃厚飼料多給群には、粗飼料多給群と同様の飼料から濃厚飼料多給(1日あたり乾草0.5kg、市販の配合飼料5kg、圧ペン大麦7kg)に切り替え4週間の給餌試験を行い、定時ごとの採材と各種測定・分析および臨床症状の観察を実施した。
LPS(エンドトシキン)の第1胃内動態の結果は
濃厚飼料多給前(Pre)の第1胃液LPS濃度は514±287 ng/mlであったが、飼料変換1日後には約4倍の2,015±1,295 ng/mlと有意に増加した。7日後から2回目のLPS濃度の著増が始まり14日後には約23倍の12,006±8,258 ng/mlに達し、28日後には3,390±4,375 ng/mlになった。
LPS(エンドトキシン)の頸静脈血液中の動態の結果は
濃厚飼料多給群のPre~1日後までは全頭の頸静脈血液にLPSは検出されなかったが、2日後に3.8±5.2 pg/mlとLPSが検出されて徐々にLPS濃度は増加し、5日後には12.7±8.6 pg/ml、21日後には20±20 pg/mlに達した
LPS(エンドトキシン)の第1胃静脈血液の動態の結果は
濃厚飼料多給群のPre~1日後までは16.9~48.7 pg/mlで推移していたが、2日後以降から増加し始め5日後には209±90 pg/mlに達し、一旦低下したのち21日後に再度増加(152±8 pg/ml)した。
とある。つまり粗飼料多給牛群でも第1胃内にエンドトキシンが存在し、第1胃静脈血にも存在するが末梢血液(全身に巡回している血液中)にはエンドトキシンは存在しなかった。
その後濃厚飼料多給すると第1胃内エンドトキシンが急増し、第1胃静脈血のエンドトキシンが増え、末梢血液にエンドトキシンが検出された。
第一胃液LPS濃度の増加に伴い、第一胃静脈血液LPS濃度が増加し、続いて末梢血液中にLPSが検出された。
また興味深い記述が続く
第一胃静脈血液中のLPS濃度が約40 pg/ml以下の場合は、末梢血液中にはLPSが検出されないことから、牛では第一胃静脈ー門脈を介して肝臓に流入するLPS濃度が40 pg/mlを超えると肝臓での解毒の処理限界を超えて、末梢血液中にLPSが検出されLPS血症を発症することが推察される。
また肝臓の役割、腸管からのエンドトキシン吸収について
肝臓は、血液中のLPSを除去する重要な臓器で、静脈内投与されたLPSの80%以上は肝臓のクッパー細胞により貪食・解毒される。健康なヒトでも腸内細菌が存在する腸管内にはLPSが産生されており、微量のLPSが腸管から吸収され門脈に入るが、肝臓のクッパー細胞で処理されるため大循環にはほとんど入らないことが知られている。
以上まとめると
- 粗飼料多給牛の第1胃、第1胃静脈血内にはエンドトキシンが存在するが、末梢血液中には存在しない。
- 濃厚飼料多給により第1胃内、第1胃静脈血内のエンドトキシンは著増し、末梢血液中にエンドトキシンが検出される。
- 肝臓に流入するエンドトキシン濃度が40 pg/ml(pgはピコグラム:ナノグラムの1000分の1、マイクログラムの100万分の1)を超えると肝臓での解毒限界を超え末梢血液中にエンドトキシンがあふれ出てエンドトキシン血症を発祥する。
- 腸管からもエンドトキシンを吸収する。
牛においてエンドトキシンがどこから来て、どのように吸収されるかを見てきました。次回は上記以外の吸収について考えてみたいと思います。
畜産現場で気をつけるべき 人の病気③ サルモネラ、パスツレラなど
サルモネラも人畜共通感染症です
サルモネラ菌とは
我々牛に携わる人にとってサルモネラ菌はサルモネラ・ダブリン、サルモネラ・ティフィミリウム、サルモネラ・エンテリティディス、サルモネラ・コレラエスイスの4種がとても重要ですが、そもそもサルモネラ菌ってどれくらいの種類があるのだろうか?と調べてみるとなんと2,500種類もあるそうです。
そしてその中でサルモネラ症の原因菌は1,400種もある様です。日本国内で全国レベルで発生した食品に由来したサルモネラ症として1980年代後半から急激に増加した鶏由来のサルモネラ・エンティリティディスによる食中毒の事例があるようです。
鶏のサルモネラについては生卵でサルモネラ症の危険がある程度の認識しかありませんでした。まさか牛で問題となるサルモネラ・エンティリティディスと同じ血清型であるとは不勉強にもほどがありますね
一般的にはサルモネラ症は動物に由来(卵、肉など)しますが、畜産現場では直接経口的に、あるいは手についたサルモネラ菌をよく洗わないで食事するなどにより感染します。
症状は下痢、嘔吐、腹痛、悪寒、発熱、頭痛などです。特に腹痛については立っていられない程度と表現されます。
ある時子牛のサルモネラ症が発生していた牧場の子牛担当者が腹痛と酷い下痢で休んでいました。「あれっ?今日休み?」と聞いたらそんな事で「牛のサルモネラに感染した可能性があるからすぐ電話して、お医者さんに牧場で働いている事と、今担当牛舎でサルモネラが発生している事を言う様に伝えて!」と小パニックになった事がありました。幸い陰性でしたが….
大腸菌症
大腸菌は人や動物の腸内に普通に存在しています。大腸菌はいわゆる「ばい菌」であるとは知っているけど破傷風やクリプトスポリジウム、サルモネラと同じ人畜共通感染症として大事なの?という疑問はあるでしょう。
破傷風という病気 またクロストリジウムの話になってしまいます… サルモネラも人畜共通感染症です サルモネラ菌とは 我々… 人畜共通感染症の続き クリプトスポリジウム症 牛の世界に… 人畜共通感染症を知っていますか? 人畜共通感染症とは 人も…破傷風の開帳姿勢と筋肉振戦(動画)
畜産現場で気をつけるべき 人の病気③ サルモネラ、パスツレラなど
畜産現場で気をつけるべき 人の病気②クリプトスポリジウム症
畜産現場で気をつけるべき 人の病気 破傷風
腸管出血性大腸菌というものがあります。wikipediaから引用します
腸管出血性大腸菌とはベロ毒素、または志賀毒素と呼ばれている毒素を産生することで病原性をもった大腸菌である「病原性大腸菌」の一種である。このためベロ毒素産生性大腸菌、志賀毒素産生性大腸菌とも呼ばれる。この菌の代表的な血清型別には、O157が存在する。
O157を知らない方は居ないでしょう。1990年埼玉県浦和市の幼稚園で井戸水が原因の食中毒が発生しました(園児2人が死亡)、また1996年大阪府堺市で小学校の学校給食で出された食品がO157に汚染されており9000人を超える集団感染が発生(小学生4人が死亡)しました。
ユッケや生レバーが食べられなくなった原因ですね。
一般的には汚染された食品を食べる事で感染しますが、サルモネラ同様畜産現場では直接傾向的に摂取してしまうリスクがあります。
人が大腸菌症を発症するのに必要な菌数はわずか50個程度です。非常に酸に強く胃酸で失活すること無く腸まで到達します。
人での大腸菌症の症状
恐ろしい病気であるのは確かですが場合によっては無症状や軽い下痢で済む事もあります。但し酷い場合激しい腹痛、頻回の水様便、激しい下血が見られる事があり、亡くなる場合もあります。
感染者の約半数は3~8日の潜伏期間の後、激しい腹痛と頻回の下痢の症状が出ます。その翌日には血便が見られますが当初は血の量はわずかです。その後次第に出血量が増え、典型的な症状で血液がそのまま出ている様な状況になる。サルモネラに比べると嘔吐は少ない様です。
畜産現場では下痢という病気があまりにも当たり前で我々も慣れてしまっていますが、とにかく畜産現場で働く全ての人は下痢に対して非常に注意が必要です。
牛皮膚糸状菌症
牛に携わる人で見た事無い人はまず居ないであろう病気。ここ十勝地方では「ガンベ」とか「トクフク」と呼ばれています。
原因はTorichophyton verrucosum(トリコフィトン ベルコーサム)という真菌(カビ)です。子牛から育成牛で見られ主に頭から首、目の周りなどに出来ます。皮膚が円形に禿げ痒みを伴います。
抵抗力の弱い牛で出ると言われていますが、1度感染して治れば2度は罹りません。
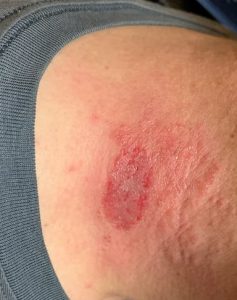
牛における皮膚糸状菌症の詳細については別の機会にするとして今回は人畜共通感染症としての皮膚糸状菌症について書いていきます。
人の水虫やタムシと同じ原因で、人に感染してパッと見るとタムシそのものです。非常に痒いです。人によってはタムシの様な病巣でなくかなり腫れ上がる人もいます。
牛の現場で働く人でやたら痒いという人は直ぐに皮膚科に行きましょう。放っておいて治るものではありません。
この写真はなんと恥ずかしながら私です。この地域の皮膚科では珍しく無いのか「猫か牛飼ってますか?」と直ぐ聞かれました。お?猫が最初に来るか~と思った記憶があります。
検査がとても痛い。患部をヘラの様なものでガリガリ血が出るくらい削って顕微鏡で見る様です。「当たりでしたね」との事
抗真菌薬の飲み薬と塗り薬を処方され、最終的に治るまで1ヶ月かかりました。私は直径3~5cmくらいでしたが、もっとずっと大きくなる人も居るようです。
パスツレラ症
牛に携わる人なら一度は聞いた事があるパスツレラ症。実は人畜共通感染症なんです。
私が学生だった頃パスツレラ症が人畜共通感染症だと習った記憶が無いような?と思ってちょっと調べてみると気になる記述を見つけました。
人のパスツレラ症は症例が多くない病ですが、近年は増加傾向にあるそうです。色々な要因があるのですが実は検査技術が向上したことで、今までペット等から感染する「原因不明の病気」がパスツレラ症だ、と判った事も一つの要因であるそうです。
そう言えば人畜共通感染症に「猫ひっかき病」というものがあった様な気がする。
一般的なパスツレラ症の感染源
猫のほぼ100%近く、犬の75%近くが保菌しているとの事。しかし犬、猫がパスツレラ症を発症することはほとんど無い。犬や猫に噛まれたり引っ掻かれる事で感染します。発症すると数時間で患部が赤く腫れ上がり痛みや発熱があります。リンパ節が腫れたり蜂窩織炎(ほうかしきえん)を起こしたりします。
この蜂窩織炎、牛でもよくありフレグモーネと呼ばれる事もあります。非常に治りにくい厄介な病気です。皮膚とその下の皮膚脂肪の間に細菌感染して皮下で広がっていく炎症です。
この場合の蜂窩織炎はパスツレラ・マルトシーダという菌による感染です。
以前はパスツレラ症は蜂窩織炎や皮膚化膿症として認識されていた様ですが、近年は呼吸器疾患、骨髄炎、髄膜炎、敗血症など重篤な症状に進行する可能性があると言われる様になりました。
私の不勉強のせいではあるのですが、私たち世代ではパスツレラ症が人畜共通感染症である事を知らない人も多いのではないかと思います。
牛におけるパスツレラ症
色々調べてみると牛におけるパスツレラ症は敗血症を引き起こすという紹介が多いようです。我々とは少し認識が違うような….
牛ではごくごく当たり前の「肺炎の原因菌」です。もちろん他の細菌やウィルスと混合感染すれば重篤な症状になる事もありますが、パスツレラより厄介な細菌もあるので一級の警戒をするというほどの細菌ではないのです。
牛の鼓張症
鼓張症について考えてみましょう
鼓張症といっても様々
牛の鼓張症は急性鼓張症であっても、慢性鼓張症であっても牧場に与える損害はとても大きいものです。少しでも減らす事が出来れば商品化率(育成牧場なら正常に素牛出荷、肥育牧場なら途中出荷されない)が上がり、収益も上がります。
哺乳中の子牛でみられる鼓張症
北海道の様に濡れ子(生後1週間~2週間の子牛)を買って、素牛まで育て販売するという育成牧場がそれ程多くない地域や母牛に子牛をつけて哺乳させている場合はあまり見る機会がないかもしれません。
私自身もNOSAI診療所時代や黒毛和牛繁殖牧場に勤務していた時には経験した覚えが無いと思います。
哺乳期の鼓張症はルーメンドリンカー(ルーメン:牛の第1胃 で飲む牛という意味です)という病気です。
本来子牛のミルクを消化するのは4つある牛の胃袋の内4番目の第4胃です。4つの胃の繋がりは口から食道、第1胃、第2胃、第3胃そして第4胃、その後小腸へと順に繋がっています。
普通に考えれば子牛が飲んだミルクは食道から第1胃に入って順に移動して第4胃に入ると思うでしょう。しかしミルクは第1胃には入りません。
子牛がミルクを飲むと第2胃が筒状に変形し食道から来るミルクをそのまま第3胃にバイパスさせるのです。この第2胃の動きを第2胃溝反射といいます。
子牛の中には生まれながら第2胃溝反射が十分でない牛がいます。また今までルーメンドリンカーでは無かった牛が急にルーメンドリンカーになる事もあります。今まで見たルーメンドリンカーは後者が圧倒的に多かったです。
後天的にルーメンドリンカーになる理由は定かでは無く、その様な文献も見つかりませんでした。但し後天的になる牛は治療中(肺炎)もしくは治療後の牛に多い様な気がして胸膜の癒着などが原因になっているのかも?と考えています。
長くなりましたが、ルーメンドリンカー(ミルクが第1胃に入る事で起きる鼓張症)は本来第1胃へ入らないミルクが第1胃に落ち異常発酵している状態です。
ルーメンドリンカーへの対応
- バケツ哺乳している場合は哺乳瓶に変更してみる。本来子牛がミルクを飲む姿勢は斜め上に口を突き上げる姿勢が自然なので本来の姿勢で飲ませる。
- 哺乳瓶で哺乳している場合は乳首を新しものに変更する。一度に飲み込むミルクの量を減らして、少しでも第1胃に落ちるミルクを減らす。
- マミーズマンマプラスを下の写真のように乳首に被せる事で一度に飲み込むミルクの量を減らせます。哺乳瓶でも哺乳バケツでも使用可能です。本来子牛の誤嚥を低減させる為に開発された様です。ミルクをの飲むと直ぐ咳き込んで、ミルクを飲むのを休んでしまう牛が居ます。そんな時にも使います。とても良い商品です。詳しくは販売元ホームページから確認して下さい(販売元:合同会社日本IMI)https://japan-imi-llc.com/mommysmanmaplus/
- ミルクを飲ませた後、健胃剤(トルラミンやボバクチン)を別途飲ませて異常発酵を抑える。
- 離乳までまだまだの子牛で、上記で全く効果が無い場合にはスーターターの上に直接ミルクの粉をかけて食べさせる事もあります。
- 離乳時期より早く、スーターターの食下量が足りていない場合でも離乳する事もあります。離乳後の増体は悪くなりますが何度も鼓張症を繰り返す事で第1胃弛緩症(前胃アトニー、ルーメンアトニーともいい第1胃の筋肉が弛緩してしまう病気)となり早期離乳より増体に悪い影響があると判断した場合です。



離乳期から育成期の鼓張症

左の写真は配合飼料を食べると鼓張症を発症しホースでガスを抜きという状況が1か月程続いた牛です。慢性鼓張症になり、痩せてしまっています。
3か月齢くらいの牛です。そもそもこの月齢では配合飼料を食べすぎて鼓張症になる、という程の量は食べません。
牛が鼓張症になる場合(一番最初に鼓張症を発症した時は全てが急性鼓張症です。その後経過が長くなり慢性鼓張症となります)
- 食べた配合飼料が第1胃で発酵して出たガス(プロピオン酸、酢酸、酪酸)を吸収する能力が低下しているケース
- 第1胃以降肛門までの間で食べて発酵した粗飼料や配合飼料が通過しにくい状態(通過障害)でおならが出にくいケース
- 何らかの理由で曖気(ゲップ)が出ない(出にくい)ケースがあります。
①のガスを吸収する能力が低下している場合は子牛から育成期と肥育期で分けて考える必要があります。
 上の写真の真ん中あたりと下の写真の右の方につぶつぶした毛の様なものがあります。
上の写真の真ん中あたりと下の写真の右の方につぶつぶした毛の様なものがあります。
これは肥育牛の第1胃の内側です。
毛の様なものは第1胃の絨毛(じゅうもう)といいます。第1胃で発酵したガスはこの絨毛から吸収され栄養となります(それ以外の仕組みでも栄養を吸収しますがそれはいずれ)
生まれて間もない子牛の第1胃は未発達で絨毛はありません。下の写真の左側の様に。

子牛の絨毛を成長させるのに大事なのはスターターです。スターターの食い込みが少ないと絨毛は発達しません。
最近は分かりませんが私が配合飼料会社にいた頃は「スターターは700g食べたら離乳して良い」というのが一般的でした。単純には言えませんが、スターター700gを食べて離乳する牛と1500g食べて離乳する牛とは絨毛の発達が2倍違うとも考えられます。
3か月齢くらいで配合飼料の食下量が増えてくると絨毛が発達していない牛はガスを吸収しきれなくて鼓張症になるのです。
確かにスターターは育成飼料より高価です。しかしここで失敗すると1頭牛をダメにしてしまう事になります。
肥育牛での鼓張症
肥育牛でも先の1~3の原因で鼓張症になります。但し1のケースはスターターの食い込み不足が原因ではなく、
- 粗飼料の給与量が少なく、ルーメンマットが形成されない(第1胃の中の水分に粗飼料が浮いて粗飼料の層が出来ます。その上に配合飼料が乗る事で配合飼料は徐々に発酵します)事で急激にガスが発生する。
- 粗飼料より配合飼料を先に給与すると上記と同じ理由で急激にガスが発生する。
- 和牛や交雑種では肥育中期でビタミンAを制限します。後述しますがビタミンAは粘膜の正常性を維持するのに必要です。絨毛も粘膜です。絨毛が正常でなくなりガスを吸収できなくなるのです。
などのケースです。昔ですが伺った肥育牧場で「配合を食い込ませるために粗飼料は800gしか与えない」という方がいました。粗飼料が少ないと鼓張症にならずとも反芻が少なくなり唾液が減り(唾液はアルカリ性)アシドーシスになり、ルーメンパラケラトーシス(第1胃角化不全症)になり、肝臓を傷めて廃棄が増え、蹄葉炎(つっぱり病)が増える事になり、増体が悪くなります。
鼓張症への対応
鼓張症の牛を見つけたらまずガスを抜く事が第一です。但しちょっと膨らんでいて、それ以上膨らまないそして牛が苦しそうにしていない場合はあわててホースを入れなくて大丈夫です。反対にホースで食道を傷つけるリスクもありますから。
泡沫性の鼓張症の場合泡立っているのでホースでは抜けない事もよくあります。ガストリンやガスナインなどの消泡剤を飲ませます。若い頃にサラダ油と酢を混ぜて飲ませる方法もあると聞いた事があります(やった事はありません)が、調べると~油が良いという情報がいろいろある様です。
緊急の場合には静脈注射用の針を刺してガスを抜きます。何本か刺しても大丈夫です。
そしてよく見るのはガスを抜いて終わりという牧場です。ここでトルラミンやボバクチンを飲ませておくと再発をかなり減らす事が出来ます。

育成牛でも肥育牛でもビタミンAと亜鉛を与えます。ビタミンAと亜鉛は上皮、粘膜の正常性の維持に必要です。特に頭頂から首にフケが浮いている牛には。フケが浮くという事は上皮が正常では無いという事で、第1胃の絨毛も正常では無い可能性があるからです。
2のケースでは状況に応じて腸の蠕動を促す薬を使ったり下剤を使ったりします。
3のケースでは左のルーメンファイブを飲ませます。ある程度の大きさの牛でないと食道で詰まりますので育成牛では注意が必要です。
直径3cmくらいでしょうか。第1胃で外側のピンクの包装が溶けて丸いタワシの様になります。このタワシが食道出口や第1胃入口を刺激してゲップを出させるというものです。肥育牛ならあ3本くらい。タワシは出荷まで取り出しません。

ルーメンファイブには肉牛用と搾乳牛用がある様です。おそらく肥育牛は生後30か月齢までには出荷されてしまうから耐久性が違うという事なのかと思います。
ルーメンファイブの詳細は名和産業株式会社HPからhttp://www.meiwa-sangyo.co.jp/products.html
畜産現場で気をつけるべき 人の病気②クリプトスポリジウム症
人畜共通感染症の続き
クリプトスポリジウム症
牛の世界に居ないとなかなか聞く機会の無い「クリプトスポリジウム症」という病気。実は人の感染は1976年に初めて報告され、それまでは牛や豚、犬、猫の病気でした。
日本で人が感染したという報告はなんと1994年でした。26年前です。26年前は石垣島の牧場で働いていまして、東京のなんとか大学の先生が牛のクリプトスポリジウムの保有状況を知りたいと調査に来た事がありました。
23年~25年前くらいだったと思います。日本での初感染報告を受けての調査だったのかと腑に落ちました。
ふと、当時から牛のクリプトスポリジウム症って今の様に問題になってたっけ?とおもいました。NOSAI診療所に居た時「子牛のクリプトスポリジウム症」なんて知らなかったような……ただの不勉強って可能性も大ですが。
畜産現場でのクリプトスポリジウム感染症
子牛ではせいぜい生後1ヶ月齢くらいまでしか問題にならないクリプトスポリジウム症ですが、人では年齢はあまり関係ありません。
感染した動物(ここでは牛)は糞1g中に数百万のオーシスト(卵だと思って良いです)を排出し、なんとオーシスト1個~数個で感染が成立し発症します。
畜産現場で感染するリスクが高まるのは主に子牛の管理に携わる人です。初めて畜産現場(子牛の居る)で働く人は何日かで激しい下痢を経験します。その他の症状は腹痛、嘔吐、脱水、軽度の発熱があります。およそ1週間程度続きます。
ほとんどの人は自然に回復するので心配は要りませんが、下痢の症状が無くなっても2~3週間は便にオーシストを排出し続けます。同居家族に赤ちゃんや抵抗力の弱い高齢者が居る場合は注意が必要です。
家庭内での感染を防ぐのは重要ですが、一般的な除菌剤、消毒薬などは効果がありません。塩素系消毒薬も全く効果がないのです。
70℃2分間加熱、乾燥しかありません。現実的な対応は手をよく流水で洗う事くらいです。
子牛でのクリプトスポリジウム症を見てみましょう
クリプトスポリジウム症の原因
牛が下痢をする場合消化不良を除き次の病原体が関与しています。
- 細菌
- ウィルス
- 原虫
- 寄生虫
上記の内一つの病原体が原因で下痢をしている場合もありますが、多くは複数の病原体が関与していると考える方が良いでしょう。
クロストリジウムはこの中の原虫です。同じく下痢の原因となるコクシジウムも原虫です。クロストリジウムの卵(オーシストといいます)を経口的に摂取する事で感染します。
いつの頃からか「全ての子牛の下痢にクロストリジウムが関与している」と言われる様になりました。
細菌性の下痢であっても例えば「細菌」と「クリプトスポリジウム」、ウィルス性の下痢であっても例えば「ウィルス」と「クリプトスポリジウム」と「細菌」が関与している、という意味です。
特にクリプトスポリジウム症は生後間もない子牛から1ヶ月齢くらいの牛で問題になります。抵抗力の弱い子牛で色んな病原体が混合感染して下痢を起こしているという事なのでしょう。
実際に糞便を検査するとクロストリジウムが検出されない場合もありますが、それ程子牛の下痢にクロストリジウムが関与しているケースが多いと認識するのが良いと思います。
クリプトスポリジウム症の症状(牛)
下痢と脱水が主症状です。下痢便を見てロタウイルスやコロナウィルスでの下痢と区別する事は困難です。
クリプトスポリジウム症の下痢は黄色い水様便とよく言われます。卵スープの様な下痢という表現もされます。その牛の下痢の主要な原因がクロストリジウムの場合はそうなのかも知れません。実際に黄色い水様便の場合もあります。
ただし上記の様に混合感染している場合はそうでは無い場合もあるのです。白っぽい場合もあり、水様便でなくブニュブニュ(ケーキに絞る生クリームをもう少し水っぽくした感じ)の便の場合もあります。
子牛の下痢便をこの色なら原因はこれ、こういう匂いなら原因はこれという資料をたまに拝見しますが、参考程度にご覧になった方が良いと思います。正にこれ!だと当てはまる下痢の方が少ないと思っています。
予防と治療
現状ワクチンなどの予防法はありません。また、細菌ならその細菌に効果がある抗生物質がありますが、クロストリジウムに効果のある薬もありません。
実際の現場ではネッカリッチという炭の粉を経口的に飲ませ、炭の多孔性(いっぱい穴が開いている)を利用して吸着して体外に排出するという治療をします。同時に整腸剤も投与します。あと卵黄抗体製剤も使います。
予防に関して「卵黄抗体(IgY)製剤の投与がクロストリジウム感染子牛のオーシスト排出量と血清および糞便中IgY濃度に及ぼす影響」(産業動物臨床医誌10(2):68-72、2019)によると
クロストリジウム感染症は生後1ヶ月以内の子牛に水様性下痢を引き起こす。クリプトスポリジウム症に有効な治療薬は存在しないが、子牛の下痢症に対する卵黄抗体(IgY)製剤が市販されており、これに抗クリプトスポリジウムIgYが含まれる。そこで本研究では、クリプトスポリジウム症に対する本製剤の効果を血清中および糞便中IgY動態から検討した。
その方法は
1酪農場の子牛12頭を対照群(通常哺乳)、初乳投与群(初乳に製剤60gを混合して投与)、2週投与群(初乳に60g、生後2週間まで生乳に製剤10g/日を混合して投与)の3群に分けて供試牛とした。試験期間は生後21日目までとし、血液および糞便を採取した。
そして結果は
全ての供試牛がCryptospotridium parvumに感染し、水様性下痢を発症した。糞便1gあたりの平均オーシスト数は2週投与群が、初乳投与群および対照群より有意に少なかった(p<0.05)。また、血清および糞便中の総IgY濃度および抗クロストリジウムIgY濃度は、初乳投与群および2週投与群ともに高値を示し、糞便中の総IgY濃度は生後5~14日目までは2週投与群で初乳投与群よりも有意に高かった(p<0.05)。糞便中の抗クロストリジウムIgY濃度は生後5および7日目に2週投与群で初乳投与群よりも有意に高かった(p<0.05)。本製剤の2週間の継続的な経口投与はクロストリジウム感染子牛のオーシスト排出量を減少させたことから、抗クロストリジウムIgYはクリプトスポリジウム症予防に有用である可能性が示唆された。
とある。
卵黄抗体製剤とは
私が知る範囲では2社から抗クリプトスポリジウム抗体を含む製剤が発売されています。クロストリジウムの他にサルモネラ、クロストリジウム、コロナウィルス、ロタウイルスの抗体も入っています(少なくとも1社の製剤は)。
私の行っている牧場では通常の治療をしてもなかなか止まらない下痢の時に治療として使っています。
和牛繁殖牧場などで生後1ヶ月以内の子牛下痢に悩んでいる様な場合、予防として使用するのも一つの手だと思います。1頭の子牛が亡くなるのを考えればその手間もお金も無駄にはなりません。